Законодательство РФ о программном обеспечении как медицинском изделии
Применение медицинских изделий у нас в стране регулируется Федеральным законом от 21.11.2011 No 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (http://base.garant.ru/57499516/). Статья 38 323-ФЗ гласит, что «Медицинскими изделиями являются любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека. Медицинские изделия могут признаваться взаимозаменяемыми, если они сравнимы по функциональному назначению, качественным и техническим характеристикам и способны заменить друг друга».
Исходя из этого следует, что программное обеспечение следует рассматривать как медицинское изделие (МИ), если оно используется:
- для управления медицинскими устройствами (МУ). В диагностике это регистрация и измерение физиологических параметров или биоматериала (invitro). В лечении это воздействие на организм человека, в том числе путем генерации и отображения изображений на экране компьютера, генерации звука и иных видов излучений и т.д.
- совместно с медицинскими устройствами — для приема и обработки сигналов (массивов данных), поступающих от МУ, их представления (визуализации, отображения, воспроизведения) медицинскому работнику в виде изображения, звукового потока или символов (чисел, текста и т.д.) и их документирования для последующего использования (в том числе включения в состав ЭМК). Сюда относится в том числе ПО, внешнее по отношению к МУ (может быть отдельным объектом разработки \ поставки), включая системы обработки и отображения медицинских изображений в диагностических целях (PACS), лабораторные информационные системы (ЛИС), а также системы дистанционного мониторинга пациентов.
- для хранения, обработки и передачи медицинских данных, в т.ч. документированных или вводимых врачом, или поступающих непосредственно от МУ. Формально к этому классу можно отнести очень широкий спектр ПО, включая системы ведения электронных медицинских карт (ЭМК) и медицинские информационные системы медицинских организаций (МИС МО), системы поддержки принятия врачебных решений (СППВР), а также решения на базе искусственного интеллекта, анализирующие различные медицинские данные и формирующие подсказки/предложения врачу по тактике обследования и лечения пациента, включая системы выявления патологий в медицинских изображениях, системы подбора лекарственной терапии и т.д.
В письме Росздравнадзора №01И-2358/15 от 30.12.2015 «О регистрации программного обеспечения» сказано, что ПО является медицинским изделием и подлежит государственной регистрации в Росздравнадзоре, если оно предназначено для:
- Управления работой оборудования и мониторинга за его функционированием,
- Получения от оборудования диагностических данных, их накопления и расчета в автоматическом режиме,
- Мониторинга функций организма человека и передачи полученных данных, в том числе посредством беспроводных технологий,
- Расчета параметров подбора дозы (облучения, лекарственного средства, рентгеноконтрастного вещества и т.д.),
- Для обработки данных, полученных с диагностического медицинского оборудования, передачи их на системы планирования и терапии,
- Обработки медицинских изображений, включая изменение его качества, цветового разрешения и т.д.,
- Для 3D-моделирования,
- Связи диагностического и лечебного оборудования,
- Для обработки цифровых изображений, в том числе с получением данных от диагностического оборудования в неизменном виде.
Таким образом, медицинские информационные системы, системы поддержки принятия врачебных решений и системы искусственного интеллекта классифицируются как медицинские изделия.
Классификация медицинских изделий по степени риска
По степени риска медицинские изделия согласно ГОСТ 31508- 2012 делятся на 4 класса:
1 — изделия с низкой степенью риска. Преимущественно это спецодежда медиков (костюмы, халаты), а также одноразовые маски, перчатки, респираторы.
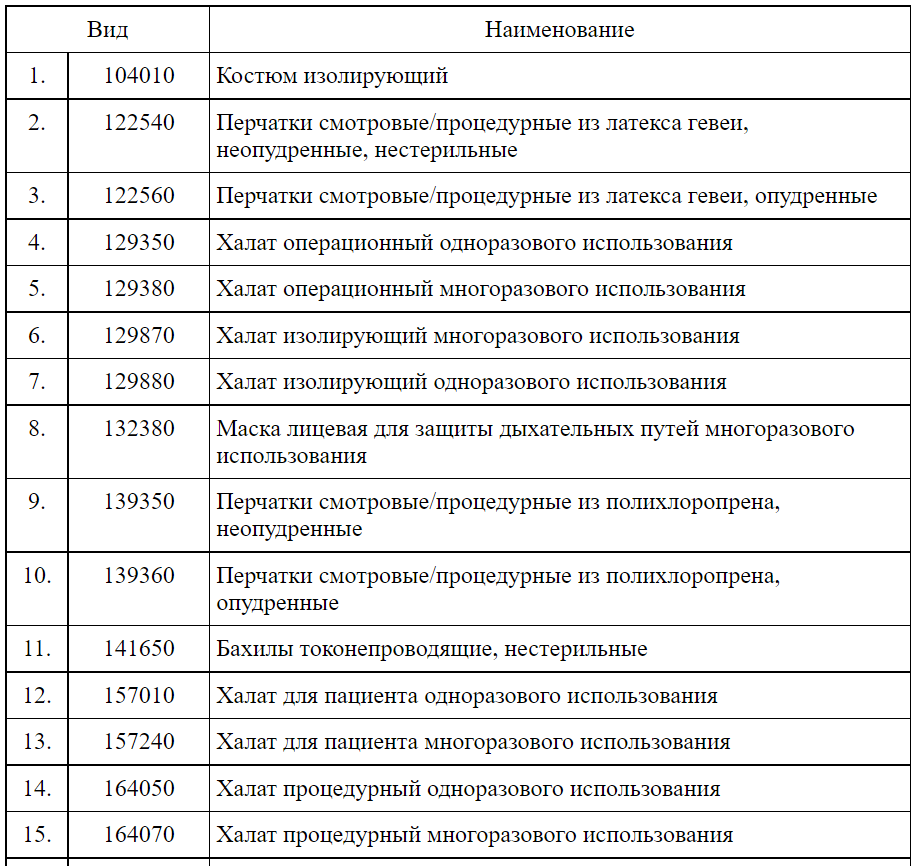
Перечень медицинских изделий 1 класса — изделия с низкой степенью риска
2а — изделия со средней степенью риска. Это техника общего применения: кислородные аппараты, контактные линзы, слуховые аппараты и так далее.
2б — изделия с повышенной степенью риска. Здесь речь о пульсоксиметрах, электрокардиографах, электрокардиоскопах, аппаратах для внутривенного и ингаляционного наркоза и прочее.
3 — изделия с высокой степенью риска. Это самая серьезная техника: аппараты для гемодиализа и искусственного кровообращения, литотрипторы, кардиостимуляторы.
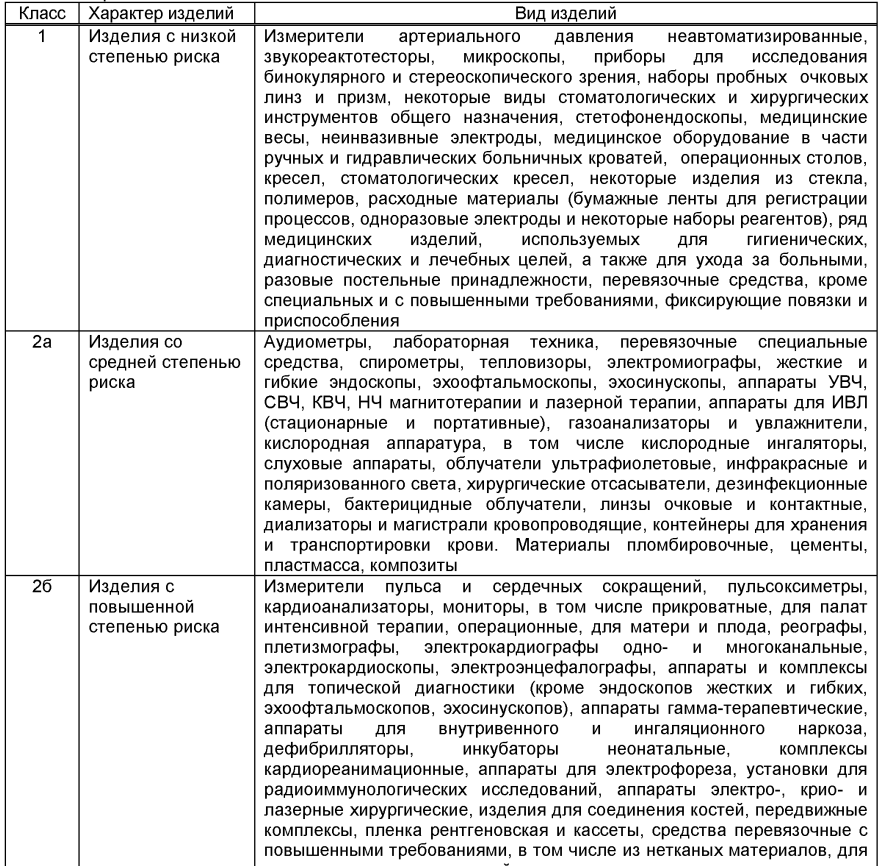
Ориентировочная классификация медицинских изделий по степени риска применения (ГОСТ 31508- 2012)
В контексте регистрации медицинских изделий надо знать следующее: порядок получения документов для изделий 1 класса (с низкой степенью риска применения) и изделий классов 2а, 2б и 3 будут отличаться. Для изделий с низкой степенью риска процедура проще и дешевле, а вся процедура занимает чуть меньше времени.
Как получить медицинскую лицензию
Для получения медицинской лицензии надо:
- Собрать пакет необходимых документов и направить его в лицензирующий орган.
ОБРАТИТЕ ВНИМАНИЕ! Функции лицензирующего органа исполняют несколько государственных структур. Как правило, это территориальные подразделения Росздравнадзора
Документы необходимо передавать в территориальный орган по месту жительства ИП или месту регистрации организации, даже если лицензия получается для филиала компании (п. 3 письма Минздравсоцразвития от 14.03.2008 № 537-12).
Но если соискатель специального разрешения не подведомственен Росздравнадзору, тогда функции лицензирующего органа исполняет региональный орган исполнительной власти (подп. «б» п. 2 положения о лицензировании). В разных субъектах они отличаются, например:
- в Москве это департамент здравоохранения города;
- Санкт-Петербурге — комитет по здравоохранению;
- Московской области — минздрав субъекта РФ.
- Дождаться проведения лицензирующим органом административных процедур. Если документы передавались в Росздравнадзор, то в соответствии с Административным регламентом решение о предоставлении или отказе в предоставлении разрешения принимается за 45 рабочих дней со дня поступления документов, в течение которых:
- полученное заявление и документы регистрируются;
- назначается ответственный исполнитель, который проверяет пакет документов и сравнивает представленную информацию со сведениями, полученными в результате межведомственного обмена, проводит внеплановые проверки, а также готовит проект приказа о предоставлении или отказе в выдаче разрешения;
- руководитель территориального органа Росздравнадзора рассматривает проект приказа и документы, на которых основано содержащееся в нем решение (при одобрении решения он подписывает приказ и лицензию; данные о выданном разрешении одновременно заносятся в реестр медицинских лицензий).
- Получить лицензию при личном посещении или по почте.
ВНИМАНИЕ! За предоставление и переоформление лицензии уплачивается госпошлина в размерах, установленных пп 92 п 1 ст 333.33 НК РФ
Видео:Оценка соответствия медицинских изделийСкачать

Почему компании отдают предпочтение именно нам?
 Компания ООО «ЕЦЭС КВОЛИТИ» в течение длительного времени сотрудничает с ведущими сотрудниками Росздравнадзора, что позволяет нам отслеживать обновления всей юридической документации и внимательно относиться к требованиям каждого заказчика.
Компания ООО «ЕЦЭС КВОЛИТИ» в течение длительного времени сотрудничает с ведущими сотрудниками Росздравнадзора, что позволяет нам отслеживать обновления всей юридической документации и внимательно относиться к требованиям каждого заказчика.
Обратившись в ООО «ЕЦЭС КВОЛИТИ», каждый клиент может рассчитывать на оказание всех необходимых услуг в сфере регистрации медицинской продукции. Мы готовы обеспечить профессиональное документальное сопровождение и грамотную консультацию при возникновении любых сопутствующих вопросов.
В услуги регистрации медицинских изделий нашей компании входят:
- Проверка и внесение изменений в сопроводительную документацию;
- Квалифицированная поддержка на всех этапах лабораторных исследований;
- Создание досье на все товары оздоровительного назначения;
- Сбор документации на начальной стадии проведения экспертизы;
- Грамотная юридическая консультация в течение всего процесса регистрации.
Какие лица имеют право на получение лицензии
Соискателями на получение лицензии могут быть медицинские и иные организации, а также ИП, которые:
- Намерены выполнять работы и оказывать услуги, упомянутые в специальном Перечне (см. приложение к положению о лицензировании).
- Соответствуют лицензионным требованиям (п. 4 положения о лицензировании), в т. ч. таким, как:
- наличие у соискателя на праве собственности или ином законном основании:
- строения, здания, сооружения или помещения, на территории которых могут оказываться медуслуги и выполняться медработы (такая недвижимость должна соответствовать требованиям СанПиН 2.1.3.26-30-10, утв. постановлением Главного государственного санитарного врача России от 18.05.2010 № 58);
- медицинских изделий (приборов, инструментов, аппаратов и т. д.), зарегистрированных в соответствии с требованиями правил, утв. постановлением Правительства РФ от 27.12.2012 № 1416;
- наличие у руководителя медорганизации, его заместителей и руководителей представительств и филиалов, ответственных за осуществление медицинской деятельности:
- высшего медицинского, послевузовского или дополнительного профессионального образования, соответствующего квалификационным требованиям (см. приложение к приказу Минздрава от 08.10.2015 № 707н), и сертификата специалиста;
- дополнительного профессионального образования и сертификата специалиста по направлению «организация здравоохранения и общественное здоровье».
Если соискателем является ИП, то получать дополнительное образование по направлению «организация здравоохранения…» ему не требуется. А если предприниматель намерен оказывать доврачебную помощь, то ему понадобится сертификат соответствующей направленности и среднее медицинское образование.
У перечисленных лиц должен быть стаж работы:
- 5 и более лет — при наличии высшего образования;
- 3 года и более — при среднем.
Видео:Новые требования получения лицензии на производство и техническое обслуживание медицинской техникиСкачать

Госпошлина и стоимость проведения лабораторных исследований и испытаний
 Таким образом, на момент подачи Досье в экспертную организацию, каждый заявитель должен оплатить государственную пошлину за государственную регистрацию медицинского изделия в размере — 11 000,00 рублей.
Таким образом, на момент подачи Досье в экспертную организацию, каждый заявитель должен оплатить государственную пошлину за государственную регистрацию медицинского изделия в размере — 11 000,00 рублей.
Стоимость государственной пошлины за проведение экспертизы качества эффективности и безопасности медицинского изделия определяется категорией риска, в которую входит то или иное изделие. Например, если выполняется регистрация медицинских изделий 3-го класса, то госпошлина оплачивается 115 000 рублей.
Регистрация медицинских изделий:
- Для 1-го класса — 72 000,00 рублей;
- класс 2а — 104 000,00 рублей;
- класс 2б — 136 000,00 рублей;
- класс 3 — 184 000,00 рублей.
Проведение испытаний с целью государственной регистрации медицинских изделий, является одним из самых важных этапов работы, к которому можно приступить только после окончательной разработки технической и эксплуатационной документации на регистрируемое медицинское изделие.
Как внедрить СМК в соответствии с ГОСТ ISO 13485-2017
Для внедрения СМК организации и ИП необходимо составить документацию, которая должна включать в себя описание процедур, формы учета и регистрации их проведения.
СМК может быть оформлена в виде:
- единого документа, который будет называться «Руководство по качеству»;
- набора документов.
Процедуры, которые должны быть описаны и реализованы в рамках СМК:
- Управление помещениями.
- Управление персоналом.
- Управление оборудованием и материалами.
- Взаимодействие с владельцем.
- Управление документацией.
- Управление медицинскими изделиями владельца.
- Управление технологическими процессами.
- Взаимодействие с субподрядными организациями.
- Закупки материальных средств.
- Система внутреннего контроля качества.
Также лицензиату, у которого есть сертификат ISO 13485, нужно ежегодно проходить инспекционный аудит. Это подразумевает отслеживание изменений, управление документацией и ведение необходимых записей для предоставления свидетельств соответствия требованиям СМК.
Раздел 2. МЕДИЦИНСКОЕ ОБОРУДОВАНИЕ
Подгруппа А. Открытые
Подгруппа Б. Закрытые
Группа 2. Кровати, в т. ч. функциональные
Группа 3. Кресла
Группа 4. Столы операционные
Группа 5. Светильники
Подгруппа А. Переносные
· осветительные;
· бактерицидные;
· негатоскопы
Подгруппа Б. Стационарные
· осветительные;
· бактерицидные;
· негатоскопы.
Группа 6. Оборудование для очистки воды
Группа 7. Оборудование для профильных отделений и кабинетов
Группа 8. Оборудование фармацевтическое
Группа 9. Оборудование для лабораторий
Группа 10. Оборудование для службы кров
Группа 11. Оборудование для стерилизационных отделений
Группа 12. Оборудование для дезинфекционных отделений, в т. ч. камеры дезинфекционные
Группа 13. Оборудование для подачи газов
Группа 14. Оборудование общебольничное
Группа 15. Оборудование для утилизации медицинских отходов
Порядок регистрации медицинских изделий
Постановлением Правительства РФ от 27 декабря 2012 г. N 1416 устанавливаются требования к процедуре государственной регистрации продукции медицинского предназначения. Эти правила регулярно изменяются, что является проблематичным для большинства изготовителей и дистрибьюторов товаров медицинского назначения, так как отследить все нововведения бывает невозможно для многих участников рынка.
Очередные дополнения в порядок регистрации медицинских изделий в России были утверждены Постановлением Правительства РФ от 31 мая 2018 г. N 633. Существенное влияние на данную процедуру оказывают поправки, связанные с регулированием функций Росздравнадзора и подотчетных ему юридических лиц, занимающихся экспертной оценкой.
Например, не так давно были изданы Методические рекомендации, касающиеся проведения регистрации медицинских изделий. Они непосредственно связаны с экспертизой, выполняемой для определения эффективности, качества и безопасности товаров данной направленности.
Мы отслеживаем любые нововведения в юридической сфере, и принимаем их во внимание при сборе документации для наших заказчиков. Руководствуясь желанием оказать поддержку всем участникам рынка, далее мы представим схему регистрации медицинских изделий, в рамках которой учитывается все дополнения и поправки
Руководствуясь желанием оказать поддержку всем участникам рынка, далее мы представим схему регистрации медицинских изделий, в рамках которой учитывается все дополнения и поправки.
2022: Росздравнадзор упростил обновление ИТ-решений в области здравоохранения
В декабре 2022 года стало известно о решении Росздравнадзора упростить обновление ИТ-решений в области здравоохранения. Речь идет об упрощении внесения изменений в программное обеспечение, зарегистрированное как медизделие.
Регулятор разрешил дорабатывать софт при условии сохранения его профиля и назначения. Ведомство будет в автоматическом режиме с определенной периодичностью проверять чувствительность и специфичность ПО на датасетах, которые использовались при клинических исследованиях изделия. Показатели после обновления ПО должны быть не хуже, чем при первоначальной регистрации продукта.
Росздравнадзор упростил обновление ИТ-решений
Что касается проблематики быстрого изменения программного продукта: мы видим решение, связанное с тем подходом, что неважно, какие изменения произошли в программном продукте, нам важно, чтобы он работал не хуже. С той же чувствительностью, с той же специфичностью, как минимум не меньшей, чем было заявлено при регистрации
Конечно, если не заменяется назначение программного продукта, если мы от рентгеновских снимков не переходим на снимки другого рода или анализ других данных. В этом случае, конечно, потребуется оценка на входе на рынок, – заявил заместитель руководителя Росздравнадзора Дмитрий Павлюков.
По его словам, при условии периодической проверки программного продукта Росздравнадзор «не будет ограничивать возможности его изменения, трансформации, доработки, начиная от интерфейса и заканчивая его начинкой».
| Мы видим трек, который позволит это сделать в автоматическом режиме, с использованием тех наборов данных, на которых программный продукт проходил клинические исследования, — добавил Дмитрий Павлюков. |
Раздел 1. ОДЕЖДА МЕДИЦИНСКАЯ
Раздел 2. ОДЕЖДА И СПЕЦИАЛЬНЫЕ ПРИНАДЛЕЖНОСТИ
Раздел 3. ОДЕЖДА ДЛЯ БОЛЬНЫХ И ГИГИЕНИЧЕСКИЕ ПРИНАДЛЕЖНОСТИ
Средства для дезинфекции, дезинсекции, дератизации
Данная классификация предлагается для создания каталогов медицинских изделий и не является совершенной. Ее можно расширять, вводя дифференциацию медицинских изделий по их использованию в различных областях медицины, где принцип функционального предназначения также будет сохранен.
Наиболее частая ошибка в делении — это, конечно, изменение основания на одном из шагов деления. Характерным примером таких частых ошибок, совершаемых разработчиками классификаций, может послужить один из отечественных каталогов, где медицинские изделия классифицированы следующим образом:
Медицинское оборудование
:
· оборудование, инструменты, мебель для неонатологии и педиатрии;
· хирургические приборы и аппараты, комплектующие изделия и расходные материалы к ним;
· реанимационно-анестезиологическое оборудование и системы наблюдения за пациентом, комплектующие изделия и расходные материалы к ним ;
· оборудование терапевтическое (здесь выделены подгруппы оборудования: физиотерапевтическое, массажное, водолечебное и проч.) ;
· оборудование и инструменты для скорой и неотложной помощи;
· стоматология и т. д.
Инструменты медицинские
:
· наборы инструментов;
· отдельные инструменты, имплантаты;
· катетеры, дренажи, зонды
Хирургические материалы
…
Оборудование для вспомогательных подразделений
и т. д., и т. п.
Пытаясь проанализировать принцип создания такой классификации (данное явление характерно для многих российских каталогов), понимаешь, что здесь произошло искажение процесса обобщения — существенные свойства предметов и существующие связи между ними вовсе не принимались во внимание при операции обобщения. (При создании научных классификаций это недопустимо, поэтому профессор Ф
В. Бассин употребил для обозначения таких нарушений образное выражение — «смысловая опухоль».) В рассматриваемом случае классификация, по всей видимости, преследует цели ее создателей — размещение модулей с одним и тем же оборудованием с возможностью их дублирования и размещения в разных разделах каталога. Якобы, для удобства потребителей.
Как мы говорили, любая классификация создается для определенных целей, и выбор основания классификации диктуется как раз этой целью. «Поскольку самых разнообразных и разнородных целей может быть очень много, одна и та же группа предметов может оказаться расклассифицированной по самым разным основаниям. Цели делений, а значит и их основания, обусловливаются определенными практическими или теоретическими соображениями, к которым правила деления не имеют никакого отношения. Суть этих правил сводится к требованию, чтобы основание, раз уж оно было выбрано, в дальнейшем в пределах проводимого деления не менялось» (Ивин А. А., там же. — С. 111).
Надеемся, что предложенная нами классификация медицинских изделий позволит более точно классифицировать медицинские изделия и поможет правильно сориентировать не только отечественных производителей медицинских изделий, но и потребителей данной продукции — медицинских работников.
Стоит также и предостеречь, что значение нашей классификации не следует преувеличивать
Надежда на всеобъемлющую и в основе своей завершенную классификацию — явная утопия, так как важное с одной точки зрения может оказаться менее важным и даже вообще несущественным — с другой; деление, отвечающее одной цели, может препятствовать достижению другой цели
Пилюгин В.В., 2005
30.07.2005 17:33
Куриляк О.А.
Классификация Подгруппы Б Приборы и аппараты для лабораторных исследований очевидно далеко не рациональна. Принцып, заложенный в классификаторе — по видам лабораторных исследований не работает. Фотометр может применяться как для биохимических исследований так и для измерения концентрации гемоглобина, а так же для выполнения иммунотурбидиметрических измерений. Сегодня есть широкий спектр приборов комбинированного типа, например,приборы для измерения электролитного состава, казов крови, гематокрита, глюкозы и лактата. Задача классификации лабораторной техники очень не простая и до сих пор рационального решения не имеет.
С удовольствием готов продолжить обсуждение этой темы.
Что нужно для переоформления лицензии
- Четкое понимание от организации и ИП, в какой области они хотят начать работать согласно новым требованиям. Также им нужно понимать, по каким группам медицинских изделий они хотят работать. Группы будут прописаны в лицензии. Список групп медицинских изделий указан в приложение № 1 к постановлению правительства РФ № 2129 от 30 ноября 2021 г.
При этом в лицензии к первоначальным видам работ сервисная компания и ИП всегда смогут добавить дополнительные, если решат расширить пакет услуг. - Наличие помещений, зданий, сооружений по месту осуществления технического обслуживания медицинских изделий. Принадлежать соискателю они могут на праве собственности или на ином законном основании. Помещения не могут быть с назначением «жилое».
Согласно постановлению правительства № 1479 от 16 сентября 2020 г. (п.16 (б)), помещения не могут быть подвальными, цокольными, мансардными и другими техническими местами. - Иметь в наличии средства измерений и оборудование по заявленным группам медицинских изделий в соответствии с приложением № 2 к постановлению правительства № 2129 от 30 ноября 2021 г. Вся измерительная аппаратура должна иметь действующие свидетельства о поверке. Калибровка не проходит.
Физическое наличие приборов на момент проверки по адресу места деятельности является обязательным. Если какого-нибудь прибора не будет хватать, организация получает отказ. Также заводские номера приборов должны совпадать с номерами, которые были поданы в отдел лицензирования.
Договор аренды — тоже законное доказательство того, что данные приборы, средства измерений принадлежат организации или ИП.
Покупать оборудование необязательно. - В наличии должна быть эксплуатационная документация на медицинские изделия, которые соискатель лицензии собирается в дальнейшем обслуживать.
- Трудоустроить в штат (основное место деятельности или работа по совместительству) инженеров по ремонту и техническому обслуживанию медицинских изделий.
От количества выбранных видов деятельности зависит число сотрудников, принимаемых на работу. 1-2 вида — не менее 2 сотрудников; 3-4 вида — не менее 3 специалистов; 5 видов и более — не менее 5 сотрудников. - Обучить персонал по выбранным видам деятельности.
Все сотрудники, заявляемые в пакет документов для получения лицензии ТОМИ, должны иметь высшее или среднее профессиональное (техническое) образование.
Стаж работы по специальности не менее 3 лет и дополнительное профессиональное образование (повышение квалификации не реже одного раза в 5 лет) в сфере выполняемых работ и оказываемых услуг.
В удостоверениях о повышении квалификации теперь обязательно должны указываться классы медицинских изделий (2а, 2б, 3), на которые заявляется организация или ИП.
- Необходимо внедрить систему менеджмента качества (СМК), которая создана и функционирует в соответствии с требованиями ГОСТ ISO 13485-2017. Получить сертификат ISO 13485.
- Заручиться поддержкой опытных специалистов, у которых есть накопленный опыт в сфере получения лицензии на техническое обслуживание медицинских изделий.
Критерии отнесения ПО к медицинским изделиям
В соответствии с письмом Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) от 13.02.2020 №02И-297, ПО относится к медизделиям, если3:
-
представляет собой программу ЭВМ или её модули вне зависимости от используемой аппаратной платформы, а также способов размещения программного обеспечения и предоставления доступа к нему;
-
не является составной частью другого медицинского изделия;
-
предназначено производителем для оказания медицинской помощи;
-
результат действия программного обеспечения заключается в интерпретации в автоматическом режиме, в том числе с использованием технологий искусственного интеллекта, или по заданным медицинским работником параметрам, влияющим на принятие клинических решений, набора данных, полученных от медицинских изделий, допущенных к обращению в установленном порядке или введённых медицинскими работниками в целях оказания медицинской помощи1.
Является ли ПО медизделием?
Поясним указанные критерии:
-
ПО может быть реализовано с применением любого совместимого аппаратного решения и операционной системы. Доступ к программному обеспечению может быть получен любым способом: через мобильное приложение, браузер или другие программы, использующие веб-протоколы.
-
Часто диагностические аппараты, например электрокардиограф или УЗИ-аппарат, поставляются в комплекте с программным обеспечением. Согласно критериям Росздравнадзора, такое ПО не является медицинским изделием. Программное обеспечение должно быть автономным и рассматриваться отдельно от медоборудования.
-
ЛПУ использует широкий набор программных продуктов для различных организационных целей: статистического учёта, управления работой отделений, контроля рационального расходования средств. Но медизделием является ПО, которое предназначено для оказания медицинской помощи пациенту: мониторинга состояния, углубленной диагностики, оценки эффективности лекарственной терапии.
-
Медицинская информационная система (МИС) помогает организовать работу с данными. Она собирает и хранит сведения о пациенте: ФИО, пол, возраст, адрес, данные обследований, заключения специалистов. При этом МИС не обрабатывает информацию и не влияет на принятие клинического решения. Другая ситуация возникает, если ПО является медизделием. ИИ анализирует обезличенные данные, выявляет скрытые закономерности между диагностическими показателями, оценивает вероятность патологий. Результат его работы – это информация, которая поможет врачу правильно оценить состояние пациента и назначить терапию.
Согласно информационному письму Росздравнадзора, ПО является медизделием, если соответствует всем четырём критериям.
К какому классу риска относится ПО?
Приказ Минздрава РФ от 6 июня 2012 года № 4н устанавливает следующие классы потенциального риска применения ПО4:
-
класс 1 — программное обеспечение с низкой степенью риска;
-
класс 2а — программное обеспечение со средней степенью риска;
-
класс 2б — программное обеспечение с повышенной степенью риска;
-
класс 3 — программное обеспечение с высокой степенью риска.
При этом в приказе указано, что потенциальный класс риска ПО не зависит от класса риска медицинского изделия, в сочетании с которым оно используется.
Процесс и сроки переоформления лицензии
- Составление документации, подготовка — от 5 рабочих дней.
- Получение лицензии ГОСТ ISO 13485 — в среднем 10 рабочих дней.
- Обучение специалистов — в среднем 5 рабочих дней.
- Рассмотрение документации Росздравназдором — 15 рабочих дней.
Организация подает заявление через госуслуги. У Росздравнадзора есть срок 15 рабочих дней на решение выдать организации лицензию или нет. Примерно на десятый рабочий день выезжает инспектор, чтобы проверить оригиналы документов и наличие оборудования согласно законодательству. В случае отрицательного решения госпошлина сгорает. При отказе инспектора организация может в этот же день подать заявление повторно.
Вы можете посмотреть запись нашего совместного вебинара с компанией ПроЭксперт на тему переоформления лицензии ТОМТ и скачать файл с ответами на вопросы, которые задавались в процессе трансляции.

P.S. вебинар проводился по порядку лицензирования согласно постановлению № 1445 от 15 сентября 2020 г., которое вступило в силу 01.01.2021 г. Но так как различия между постановлением № 1445 от 15 сентября 2020 г. и новым постановлением № 2129 от 30 ноября 2021 г. сводятся к порядку подачи заявления, то вся информация, озвученная в процессе вебинара, остается актуальной.

Кирилл Федулов
Сооснователь и директор по развитию Okdesk. Около 10 лет проработал в компании Naumen, где занимался внедрением ITSM и service desk систем в крупнейших российских компаниях: Полюс, Тинькофф, ЛСР и др. Эксперт в области организации и автоматизации процессов техподдержки, сервиса и выездного обслуживания
Какие инструменты помогают соответствовать требованиям ГОСТ ISO 13485-2017
Одни из ключевых требований СМК — управление записями, прослеживаемость, контроль и мониторинг, анализ данных и обратная связь.
Например, записи в документах должны быть всегда актуальными для предоставления
свидетельств соответствия требованиям и результативного функционирования СМК.
Организации и ИП должны фиксировать и контролировать всё, что может влиять на качество обслуживания медтехники: людей, которые разрабатывают документацию; процедуры внесения изменений в документацию и т. д.
Для соответствия требованиям СМК возможно использовать несколько способов:
- Вести все записи на бумажном носителе. Такой вариант самый простой, но требует постоянного контроля и четко налаженных процессов, чтобы обеспечить взаимосвязь документов друг с другом и их прослеживаемость.
Также этот способ не позволяет проводить полноценный анализ данных и получать обратную связь от заказчиков. Например, сервисная компания провела плановое техническое обслуживание (ТО) УЗИ-аппарата. В этом случае заявка на плановое ТО должна быть оформлена на бумаге. При этом заявка должна быть привязана к клиенту, конкретному оборудованию, договору обслуживания и закрывающим документам. - Использовать стандартные инструменты учета и коммуникации. Многие организации ведут процессы сервисного обслуживания в Excel, CRM-системах, мессенджерах, 1C.
Минус такого способа автоматизации — использование нескольких инструментов одновременно. То есть специалисты сервисной компании принимают заявки в мессенджерах, отслеживают выполнение обращений в CRM-системе, учет оборудования клиента ведут в Excel.
Таким образом, нарушается прослеживаемость истории обслуживания, достаточно трудно контролировать процессы и анализировать данные. - Использовать help desk системы для автоматизации сервисного обслуживания.
Несомненное преимущество help desk, в частности Okdesk, то, что все процессы по техническому обслуживанию медтехники ведутся в одной системе. Например, такие:- управление заявками и их 100% обработка;
- учет оборудования и истории его обслуживания;
- контроль планового ТО;
- календарное планирование работ и загрузки инженеров;
- учет трудозатрат и документооборот.
Это обеспечивает взаимосвязь и прослеживаемость процессов, позволяет контролировать, анализировать их, работать с обратной связью. Благодаря этому возможно повысить качество сервисного обслуживания.
Таким образом, help desk система помогает не только настроить процессы сервисного обслуживания в соответствие с требованиями СМК, но и повысить их эффективность.
При использовании второго и третьего способа важно учитывать, что организации и ИП должны документировать процедуры валидации применения ПО, которое используют в обслуживании. Такое ПО должно быть валидировано до его первого применения
Такое ПО должно быть валидировано до его первого применения.





























